复星医药自主研发、双适应症获批 罕见病创新药芦沃美替尼获顶级药学期刊关注与认可
《Drugs》杂志是Springer Nature旗下药物及治疗领域的权威期刊(最新影响因子:14.4)。50多年来,该杂志持续刊载由国际顶尖临床医生和研究人员撰写的评论及原创临床研究成果,为临床决策提供有力支持。
近日,《Drugs》杂志刊登了复星医药自主研发的创新药芦沃美替尼(Luvometinib,商品名:复迈宁®)首次获批的深度报告。文章系统梳理了芦沃美替尼的研发里程碑及相关重要临床数据,标志着复星医药自主研发的药物获得国际学术平台的关注与认可。
药物核心信息:突破性机制与双适应症获批
芦沃美替尼是复星医药自主研发的1类的一种高选择性口服MEK1/2抑制剂,用于治疗与MAPK激活异常相关的恶性肿瘤及其他罕见疾病。
2025年5月27日,芦沃美替尼片在中国首次获批上市。本次获批两项适应症分别用于治疗:朗格汉斯细胞组织细胞增生症(LCH)和组织细胞肿瘤成人患者,以及2岁及以上伴有症状、无法手术的丛状神经纤维瘤(PN)的I型神经纤维瘤病(NF1)儿童及青少年患者。该药品上市填补了相关罕见肿瘤领域的治疗空白,为患者提供了新的治疗选择。
药学特性
高选择性的MEK1/2抑制剂
芦沃美替尼强效且高选择性地抑制MEK 1/2, 阻断MAPK通路信号的异常传导,展现出显著的抗肿瘤活性。体外实验表明,芦沃美替尼能够剂量依赖性地抑制ERK磷酸化,将肿瘤细胞阻滞在G0/G1期并诱导细胞凋亡。其剂量依赖性的抗肿瘤活性在体内试验中同样得到证实。在推荐剂量下未观察到有临床意义的 QTc 间期变化。
药代动力学优势:半衰期长,药物相互作用少
成人接受8 mg 每日一次口服给药,达稳态趋势后,平均血药峰浓度(Cmax, ss)为78.9 ng/mL, 中位达峰时间(Tmax)为2.48 h,平均稳态给药间隔内药-时曲线下面积(AUCτ)为775 ng·h/mL。半衰期30.4小时,支持每日一次给药。儿童接受5 mg/m2 每日一次给药达到稳态后,Cmax, ss 80.3 ng/mL, Tmax 2.85 h,AUCτ 883 ng·h/mL。药物主要经肝脏代谢由 UGT1A3 和 UGT2B17介导,非CYP依赖,药物相互作用少。食物、年龄(2-75岁)和轻度肾/肝功能不全对药物暴露量没有临床意义上的影响,有助于提高患者依从性。
研究布局:覆盖多个疾病领域
芦沃美替尼针对MAPK通路异常的多种相关疾病开展了系统性临床研究布局,包括NF1、LCH、低级别胶质瘤(LGG)、颅外动静脉畸形(AVM)等适应症。已完成和正在进行的临床研究总结如下:
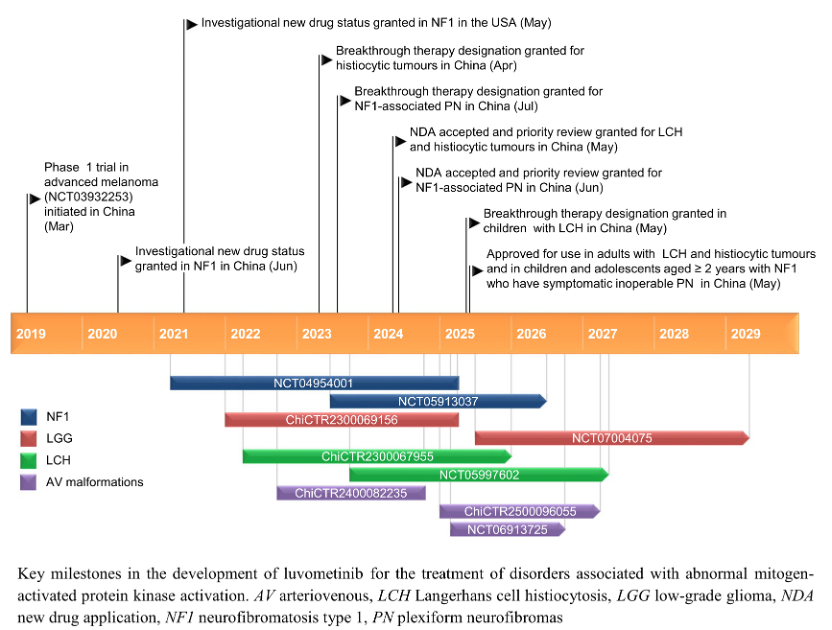
芦沃美替尼关键里程碑
关键临床数据总结
NF1-PN
儿童患者:
在I/II期研究(NCT04954001)的II期儿童队列中,芦沃美替尼证明了其抗肿瘤活性。研究中位随访25.1个月。根据REiNS标准,经研究者确认的客观缓解率(ORR)为60.5%(26例部分缓解PR)。特别值得注意的是,在基线存在肿瘤疼痛的患者中,78.6%患者实现疼痛完全缓解(疼痛评分0分),92.9% 患者的疼痛得到明显缓解(评分降幅≥2分),提示芦沃美替尼对肿瘤疼痛的改善具有临床意义。
成人患者:
在NF1-PN成人患者中,同样观察到芦沃美替尼的抗肿瘤活性。研究中位随访29.3个月,根据REiNS标准,经研究者确认的ORR为42.9%,均为PR。在基线存在肿瘤疼痛患者中,78.3%的患者疼痛评分降幅≥2分,提示芦沃美替尼对肿瘤疼痛的改善具有临床意义。
LCH/组织细胞肿瘤
成人患者:
在一项治疗成人组织细胞肿瘤(含LCH)的中国Ⅱ期研究(ChiCTR2300067955)中,芦沃美替尼展现其有效性。研究中位随访16.2个月,基于PET疗效标准(PRC)经独立评审委员会(IRC)确认的ORR达82.8%。药物起效迅速,中位至缓解时间仅2.86个月。中位缓解持续时间(DOR)尚未达到,提示长期治疗获益。
儿童患者:
在一项治疗儿童难治/复发性LCH Ⅱ期研究(NCT05997602)中,芦沃美替尼也获得突破。研究中位随访7.4个月,基于PRC标准,经IRC评估的ORR达84.0%。
儿童低级别胶质瘤(LGG)
在一项治疗儿童复发性/进展性LGG Ⅱ期研究(ChiCTR2300069156)中,芦沃美替尼证实其治疗潜力。研究中位随访7.79个月数据显示:基于神经肿瘤疗效评估标准(RANO),27.3%患者达到PR,40.9%患者实现轻微缓解,另有31.8%患者疾病稳定。
常见不良事件
成人
基于多项临床试验的汇总分析表明,接受芦沃美替尼 8 mg每日一次的成人患者(n=190)中,最常见的药物相关不良事件(发生率≥20%)为:CPK升高、皮疹、毛囊炎、口腔溃疡、AST升高、甲沟炎、腹泻、LDH升高、ALT升高和瘙痒。
最常见的≥3级药物相关不良事件(发生率≥2%)为毛囊炎(13.2%)、CPK升高(5.8%)和甲沟炎(2.1%)。
儿童
基于多项临床试验的汇总分析表明,接受芦沃美替尼 5 mg/m2每日一次的儿童患者(n=87)中,最常见的药物相关不良事件(发生率≥20%)为LDH升高、CPK升高、甲沟炎、α-羟基丁酸脱氢酶升高、口腔溃疡、皮疹、CPK MB升高和窦性心律失常。
最常见≥3级的药物相关不良事件(发生率≥2%)为CPK升高(2.3%)、毛囊炎(2.3%)和痤疮样皮炎(2.3%)。
在LCH和组织细胞肿瘤以及NF1-PN的临床试验中,接受推荐剂量治疗的患者均未出现左心室射血分数(LVEF)降低。
正在进行的临床研究
芦沃美替尼正在积极继续探索及开展多个适应症的临床研究。其中,用于治疗成人NF1-PN (NCT05913037) 和儿童LGG(NCT07004075)的临床研究处于Ⅲ期临床阶段,用于颅外AVM(ChiCTR2500096055)、儿童LCH(NCT05997602)的临床研究均处于Ⅱ期临床阶段。
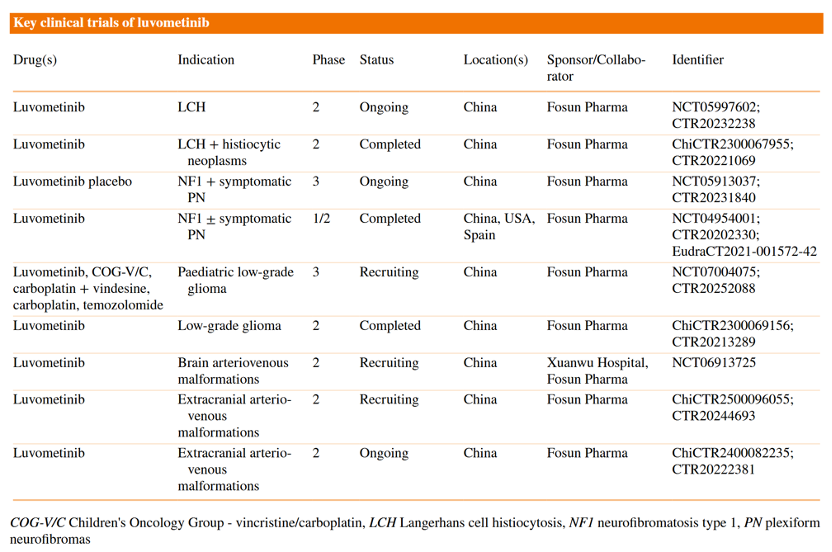
芦沃美替尼关键临床研究总结
结语
芦沃美替尼作为中国首个且目前唯一覆盖NF1-PN与LCH及组织细胞瘤双适应症的药物,其获批印证了复星医药的创新研发实力。国际知名期刊《Drugs》的深度报道系统梳理了芦沃美替尼的研发历程以及关键临床数据。这种高质量的学术传播,为全球药学研究者、临床医生及决策者提供了宝贵的循证依据和深刻的洞见。此次芦沃美替尼在《Drugs》上的重磅亮相,是复星医药实现持续投入创新研发、致力于解决未满足临床需求这一核心战略的体现。它向全球医药界清晰传递了复星医药在推动前沿疗法、提升患者获益方面的决心与实力。
*本材料为专业医学资料,仅供医疗卫生专业人士参考,具体诊疗信息请遵医嘱
参考文献
[1] Keam SJ. Luvometinib: First Approval. Drugs. Published online August 2, 2025.
[2] Tan Y, Cui A, Qian L, et al. Population pharmacokinetics of FCN-159, a MEK1/2 inhibitor, in adult patients with advanced melanoma and neurofibromatosis type 1 (NF1) and model informed dosing recommendations for NF1 pediatrics. Front Pharmacol. 2023;14:1101991.
[3] Li J, Tan Y, Li K, et al. Effect of Food (Low and High Fat) on Pharmacokinetics of FCN-159, a Selective MEK Inhibitor, in Healthy Chinese Males. Adv Ther. 2023;40(3):1074-1086.
[4] Hu X, Li W, Zeng K, et al. Phase 1 dose-escalation study to evaluate the safety, tolerability, pharmacokinetics, and anti-tumor activity of FCN-159 in adults with neurofibromatosis type 1-related unresectable plexiform neurofibromas. BMC Med. 2023;21(1):230.